Rodanase
A rodanase ou rodanese é un encima mitocondrial que detoxifica o cianuro (CN−) ao convertelo en tiocianato (SCN−, tamén coñecido como "rodanato").[1] En encimoloxía, o nome común é tiosulfato sulfurtransferase (Modelo:EC number).[2] Cataliza a seguinte reacción:
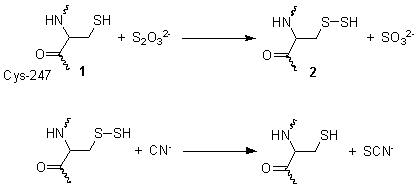
- tiosulfato + cianuro sulfito + tiocianato
Nomenclatura
Aínda que as regras de nomenclatura estándar para os encimas din que os seus nomes deben rematar en "ase" (neste caso sería rodanase), este encima é moitas veces coñecido como rodanese e así aparece en moitas bases de datos (rhodanese en inglés). Isto débese a que foi un encima descuberto en 1933,[3] antes de que se establecese a Comisión de Encimas en 1955; e daquela o nome orixinal estaba xa moi asentado e seguiu tendo un amplo uso ata os nosos días.
O nome sistemático desta clase de encimas é "tiosulfato:cianuro sulfurtransferase". Outros nomes en uso común son "tiosulfato cianuro transsulfurase", "tiosulfato tiotransferase", "tiosulfato sulfurtransferase", "rodanese" e "rodanase".
Estrutura e mecanismo
Esta reacción ten lugar en dúas etapas. O diagrama da imaxe do cadro mostra a estrutura determinada por cristalografía de raios X da rodanase. En canto o seu mecanismo de acción, o primeiro paso é que o tiosulfato é reducido polo grupo tiol da cisteína-247 (1), para formar un persulfuro e un sulfito (2). O segundo paso é a reacción do persulfuro con cianuro para producir tiocianato, rexenerando o tiol da cisteína (1).[4]
A rodanase comparte relacións evolutivas cunha gran familia de proteínas, entre a que se inclúen as seguintes:
- dominio catalítico da Cdc25 fosfatase
- dominios non catalíticos das MAPK-fosfatases de especificidade dual de eucariotas
- dominios non catalíticos das MAPK-fosfatases de tipo PTP de lévedos
- dominios non catalíticos das Ubp4, Ubp5, Ubp7 de lévedos
- dominios non catalíticos da Ubp-Y de mamíferos
- proteína de choque térmico de Drosophila HSP-67BB
- varias proteínas de choque frío bacterianas e proteína de choque de fagos
- proteínas asociadas á senescencia de plantas
- dominios catalíticos e non catalíticos da rodanase[5]
A rodanase ten unha duplicación interna. Este dominio atópase como copia simple noutras proteínas, incluíndo fosfatases e as ubiquitina C-terminal hidrolases.[6]
Importancia clínica
Esta racción é importante para o tratamento da exposición ao cianuro, xa que o tiocianato formado ten unha toxicidade 200 veces menor.[7]:p. 15938 O uso da solución do tiosulfato como antídoto para o envelenamento por cianuro está baseado na activación deste ciclo encimático.
Proteínas humanas
A rodanase mitocondrial humana é a TST.
Estes outros xenes humanos teñen o dominio "similar a rodanase" en InterPro, pero non son a rodanase coa súa actividade catalítica típica (ver tamén a lista de proteínas relacionadas da familia en #Estrutura e mecanismo):
- fosfatase indutora da fase M: CDC25A; CDC25B; CDC25C;
- proteína fosfatase de especificidade dual: DUSP; DUSP1; DUSP2; DUSP4; DUSP5; DUSP6; DUSP7; DUSP10; DUSP16, tamén chamada MKP7;
- tiosulfato:glutatión sulfurtransferase: KAT, agora chamada "TSTD1";
- adenililtransferase e sulfurtransferase: MOCS3;
- 3-mercaptopiruvato sulfurtransferase: MPST, tamén coñecida como "TSTD2"
- non é un encima: TBCK; TSGA14;
- ubiquitina carboxilo-terminal hidrolase: USP8;
- de actividade descoñecida: TSTD3
Notas
Véxase tamén
Ligazóns externas
Modelo:Commonscat Modelo:MeshName
- ↑ Modelo:Cite journal
- ↑ EC 2.8.1.1, no International Union of Biochemistry and Molecular Biology
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite web
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal