Quimiotaxe

A quimiotaxe[1] (/takse/) é o movemento dun organismo ou entidade en resposta a un estímulo químico ao longo dun gradiente.[2] As células somáticas, bacterias e outros organismos unicelulares ou pluricelulares dirixen os seus movementos segundo presenza de certas substancias químicas no seu ambiente. Isto é importante para que as bacterias atopen alimento (por exemplo, glicosa) nadando cara onde hai maior concentración das moléculas nutritivas, ou fuxindo de onde hai moléculas velenosas (por exemplo, fenol). Nos organismos pluricelulares a quimiotaxe é fundamental nas primeiras fases da reprodución e o desenvolvemento (por exemplo, o movemento dos espermatozoides cara ao óvulo durante a fecundación ou a migración de neuronas ou linfocitos ou de células nas primeiras fases do embrión), así como no funcionamento normal e mantemento da saúde do organismo (por exemplo, a migración de leucocitos durante a curación dunha lesión ou infección).[3] Ademais, sábese que os mecanismos que permiten a quimiotaxe en animais poden estar alterados durante a metástase do cancro.[4] A quimiotaxe anormal de linfocitos e outros leucocitos tamén contribúe enfermidades inflamatorias como a aterosclerose, asma e artrite.[5][6][7][8] Os compoñentes subcelulares, como o parche de polaridade xerado polos levedos en apareamento, poden tamén presentar comportamento quimiotáctico.[9]
A quimiotaxe denomínase positiva se o movemento é cara ao lugar onde hai unha maior concentración do composto químico en cuestión; denomínase quimiotaxe negativa se o movemento é na dirección oposta. A cinese causada por unha substancia química (dirixida de forma aleatoria ou non direccional) pode denominarse quimiocinese.
Historia da investigación da quimiotaxe
Aínda que a migración de células foi detectada desde a primeira época do desenvolvemento do microscopio por Leeuwenhoek, algúns autores propoñen que a primeira "descrición erudita" da quimiotaxe fíxérona máis tarde "T. W. Engelmann (1881) e W. F. Pfeffer (1884) en bacterias e H. S. Jennings (1906) en ciliados".[10] O laureado co premio Nobel I. Metchnikoff tamén contribuíu ao estudo deste tema no período de 1882 a 1886, con investigacións sobre o proceso como paso inicial para a fagocitose.[11] A importancia da quimiotaxe en bioloxía e patoloxía clínica era amplamente aceptada na década de 1930, e as definicións máis fundamentais sobre este campo foron perfiladas nesa época. Os aspectos máis importantes no control de calidade dos ensaios de quimiotaxe foron descritos por H. Harris na década de 1950.[12] Nas décadas de 1960 e 1970, a revolución da moderna bioloxía celular e bioquímica proporcionou unha serie de novas técnicas das que se podía dispoñer para investigar a resposta das células migratorias e fraccións subcelulares responsables da actividade quimiotáctica.[13] A posibilidade de usar esta tecnoloxía levou ao descubrimento de C5a, un importante factor quimiotáctico que intervén na inflamación aguda. Os traballos pioneiros de J. Adler modernizaron os ensaios en capilares de Pfeffer e representaron un punto de inflexión significativo na comprensión de todo o proceso de transdución de sinais intracelular nas bacterias.[14][15]
Características xerais da quimiotaxe bacteriana

Algunhas bacterias, como Escherichia coli, teñen varios flaxelos (de 4 a 10 normalmente). Estes poden rotar de dous xeitos:
- Rotación en contra do sentido das agullas do reloxo, que aliña os flaxelos nun só feixe rotatorio, causando que a bacteria nade en liña recta.
- Rolación no sentido das agullas do reloxo, separa o feixe de flaxelos de maneira que cada flaxelo apunta en diferente direccción, causando que a bacteria xire ou dea voltas nun lugar.[16]
As direccións de rotación indícanse respecto a un observador exterior que vexa desde arriba os flaxelos en dirección á célula.[17]
Comportamento
O movemento global dunha bacteria é o resultado do xiro alternante e das fases natatorias, chamado movemento de correr e xirar (run and tumble).[18] Como resultado, a traxectoria dunha bacteria que nade nun ambiente uniforme formará un camiño aleatorio con natacións relativamente rectas interrompidas por xiros ao chou que reorientan a bacteria.[19] Bacterias como E. coli son incapaces de elixir a dirección na cal van nadar e non poden nadar en liña recta por máis duns poucos segundos debido á difusión rotacional; noutras palabras, as bacterias "esquecen" a dirección na cal estaban avanzando. Ao avaliaren repetidamente o seu curso e axustáreno se se están movendo na dirección incorrecta, as bacterias poden dirixir o seu movemento de camiño aleatorio cara a lugares favorables.[20]
En presenza dun gradiente químico as bacterias dirixen o seu movemento global baseándose no gradiente. Se a bacteria percibe que se está movendo na dirección correcta (cara ao composto atractivo/lonxe do repelente), seguirá nadando en liña recta durante un longo tempo antes de xirar; porén, se se está movendo na dirección incorrecta, xirará antes. As bacterias como E. coli usan a percepción temporal para decidir se a súa situación está mellorando ou non, e desde xeito, atopan o lugar coa maior concentración do composto atractivo, detectando mesmo pequenas diferenzas de concentración.[21]
Este camiño aleatorio nesgado é o resultado dunha simple elección entre dous métodos de movemento aleatorio; concretamente xirando e nadando recto.[22] A natureza heicoidal do filamento flaxelar individual é esencial para que se produza este movemento. A proteína que forma o filamento flaxelar, a flaxelina, está conservada en todas as bacterias flaxeladas.[23] Os vertebrados parece que se aproveitaron deste feito ao posuiren un receptor inmune (TLR5) deseñado para recoñecer esta proteína conservada.[24]
Como en bioloxía case sempre hai excepcións, hai bacterias que non seguen esta regra. Moitas bacterias, como as Vibrio, son monoflaxeladas co seu único flaxelo situado nun polo da célula. O seu método de quimiotaxe é diferente. Outras posúen un só flaxelo pero que está dentro da parede celular; estas bacterias móvense producindo un xiro de toda a bacteria, que ten forma de sacarrollas.[25]
Transdución de sinais

Os gradientes químicos percíbense por medio de múltiples receptores transmembrana, chamados proteínas da quimiotaxe aceptoras de metilo (MCPs), que varían en canto ás moléculas que poden detectar.[26] Coñécense miles de receptores MCP codificados por especies de todo o dominio das bacterias.[27] Estes receptores poden unirse a compostos atractores ou repelentes directa ou indirectamente por interacción con proteínas do espazo periplásmico.[28] Os sinais destes receptores son transmitidos a través da membrana plasmática ao citosol, onde se activan as proteínas Che.[29] As proteínas Che alteran a frecuencia de xiros, e alteran os receptores.[29]
Regulación de flaxelos
As proteínas CheW e CheA únense ao receptor. A ausencia de activación do receptor orixina a autofosforilación da histidina quinase CheA nun só residuo de histidina moi conservado.[30] CheA, á súa vez, transfire grupos fosforilo a residuos de aspartto conservados nos reguladores da resposta CheB e CheY; CheA é unha histidina quinase e non transfire activamente o grupo fosforilo, senón que o regulador da resposta CheB toma o grupo fosforilo de CheA.[31] Este mecanismo de transdución de sinais denomínase sistema de dous compoñentes, e é unha forma común de transdución de sinais en bacterias.[32] CheY induce xiros da bacteria ao interacionar coa proteína de cambio flaxelar FliM, inducindo un cambio da rotación flaxelar en contra do sentido das agulla do reloxo a unha rotación no sentido das agullas do reloxo. Os cambios no estado de rotación dun só flaxelo poden alterar o feixe de flaxelos completo e causar o xiro.[33]
Regulación do receptor

CheB, cando é activada por CheA, actúa como unha metilesterase, retirando grupos metilo de residuos de glutamato no lado citosólico do receptor; funciona antagonistamente respecto CheR, unha metiltransferase, que engade residuos metilo aos mesmos residuos de glutamato.[34] Se o nivel dun composto atractor permanece alto, o nivel de fosforilación de CheA (e, por exemplo, CheY e CheB) permanece baixo, a célula nada suavemente, e o nivel de metilación das MCPs increméntase (porque non está presente CheB-P para desmetilar).[34] As MCPs xa non responden ao composto atractor cando están completamente metiladas; por tanto, aínda que o nivel do composto atrente poida permanecer alto, o nivel de CheA-P (e CheB-P) increméntase e a célula empeza a xirar.[34] As MCPs poden ser desmetiladas por CheB-P, e, cando isto ocorre, os receptores poden unha vez máis responder aos compostos atractores.[34] A situación é a oposta respecto aos repelentes. Esta regulación permite que a bacteria "lembre" concentracións químicas do pasado recente, pero se só uns poucos segundos, e as compare coas concentracións que está percibindo nese momento, e así "coñece" se está viaxando a favor ou en contra de gradiente. [35] Ademais, están implicados outros mecanismos no incremento do valor absoluto da sensibilidade sobre un determinado fondo. Exemplos ben establecidos son as respostas ultrasensibles do motor ao sinal CheY-P, e o agrupamento de quimiorreceptores.[36][37]
Quimioatractores e quimiorrepelentes
Os quimioatractores e quimiorrepelentes son substancias orgánicas ou inorgánicas que posúen un efecto indutor da quimiotaxe en células móbiles. Estes ligandos quimiotácticos crean gradientes de concentración a través dos cales se moven os organismos procariotas ou eucariotas, achegándose ou afastándose da zona de maior concentración, respectivamente.[38]
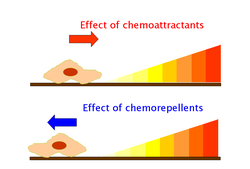
Os efectos dos quimioatractores desencadéanse por medio de quimiorreceptores como as proteínas da quimiotaxe aceptoras de metilo (MCP).[39] As MCPs de E. coli inclúen Tar, Tsr, Trg e Tap.[40] Os quimioatractores para Trg son a ribosa e galactosa, mentres que o fenol é un quimiorrepelente. Tap e Tsr recoñecen os dipéptidos e a serina como quimioatractores, respectivamente.[40]
Os quimioatractores ou quimiorrepelentes únense ás MCPs no seu dominio extracelular; despois, un dominio de sinalización intracelular envía sinais dos cambios de concentración destes ligandos quimiotácticos a proteínas de augas abaixo como CheA, que á súa vez dan o relevo deste sinal que chega aos motores flaxelares por medio de CheY fosforilada (CheY-P).[39] CheY-P pode despois controlar a rotación flaxelar influindo na dirección do movemento celular.[39]
En Escherichia coli, Sinorhizobium meliloti e Rhodobacter sphaeroides, a unión de quimioatractores ás MCPs inhibe CheA e, por tanto, a actividade de CheY-P, o que resulta en movementos rectos suaves, pero para Bacillus subtilis, a actividade de CheA increméntase.[39] Os eventos de metilación en E. coli causan que as MCPs teñan menor afinidade aos quimioatractores, o que causa un incremento da actividade de CheA e CheY-P orixinando xiros.[39] Deste xeito, as células poden adaptarse á concentración inmediata dos quimioatractores e detectan os cambios para modular a motilidade celular.[39]
Os quimioatractores en eucariotas están ben caracterizados en células inmunitarias. Os formil-péptidos, como o fMLF, atraen leucocitos, como neutrófilos e macrófagos, causando un movemento cara aos sitios de infección.[41] Os metionilil-péptidos non acilados non actúan como quimioatractores de neutrófilos e macrófagos.[41] Os leucocitos tamén se moven cara ao quimioatractor C5a, un compoñente do sistema de complemento, e a ligandos específicos de patóxenos en bacterias.[41]
Os mecanismos usados polos quimiorrepelentes son menos coñecidos que os dos quimioatractores. Aínda que os quimiorrepelentes funcionan producindo unha resposta de evitación nos organismos, Tetrahymena thermophila adáptase ao quimiorrepelente, péptido netrina 1, en só 10 minutos de exposición; porén, coa exposición a quimiorrepelentes como a GTP, PACAP-38 e nociceptina non mostra esas adaptacións.[42] O GTP e o ATP son quimiorrepelentes a concentracións micromolares tanto para Tetrahymena coma para Paramecium. Estes organismos evitan estas moléculas producindo reaccións de evitación para reorientarse e escapar da substancia ao longo do gradiente.[43]
Quimiotaxe eucariota

O mecanismo da quimiotaxe que empregan as células eucariotas é bastante diferente do da bacteria E. coli; porén, a percepción de gradientes químicos é tamén un paso crucial do proceso.[44] Debido ao seu pequeno tamaño e outras restricións biofisicas, E. coli non pode detectar directamente un gradiente de concentración.[45] No seu lugar, empregan a percepción temporal de gradiente, na que se moven a grandes distancias de varias veces a súa propia largura e miden a velocidade á que cambia a concentración química percibida.[46][47]
As células eucariotas son moito máis grandes que as procariotas e teñen receptores incrustados uniformemente na membrana plasmática.[46] A quimiotaxe eucariota implica detectar un gradiente de concentración espacialmente ao comparar a activación asimétrica destes receptores en diferentes extremos da célula.[46] A activación destes receptores resulta na migración cara a quimioatractores, ou o afastamento dos quimiorrepelentes.[46] Nos lévedos en apareamento, que non son móbiles, os parches de proteínas de polaridade do córtex da célula poden relocalizarse de maneira quimiotáctica ao longo de gradientes de feromonas.[48][9]
Tamén se demostrou que tanto as células procarioatas coma as eucariotas poden ter memoria quimiotáctica.[47][49] En procariotas este mecanismo supón a metilación de receptores chamados proteínas da quimiotaxe aceptoras de metilo (MCPs).[47] Isto ten como resultado a súa desensibilización e permite aos procariotas "lembrar" e adaptarse a un gradiente químico.[47] A diferenza disto, a memoria quimiotáctica dos eucariotas pode explicarse polo modelo de Inhibición Global Excitación Local (LEGI).[49][50] O LEGI implica o balance entre unha excitación rápida e unha inhibición atrasada que controla a sinalización augas abaixo como a activación de Ras e a produción de PIP3.[51]
Os niveis de receptores, as vías de sinalización intracelular e os mecanismos efectores representan diversos compoñentes de tipo eucariota. Nas células eucariotas unicelulares os principais efectores son o movemento ameboide e o ciliar ou do flaxelo eucariotas (por exemplo, Amoeba ou Tetrahymena).[52][53] Algunhas células eucariotas cuxa orixe son os vertebrados superiores, como as células inmunitarias tamén se moven ao sitio onde necesitn estar. Ademais das células competentes inmunitarias (granulocito, monocito, linfocito) un gran grupo de células (considerdas previamente fixas nos tecidos) son tamén móbiles en condicións fisiolóxicas especiais (por exemplo, mastocito, fibroblasto, célula endotelial) ou patolóxicas (por exemplo, metástases).[54] A quimiotaxe ten unha grande importancia nas fases temperáns da embrioxénese como o desenvolvemento das capas xerminais, que está guiado por gradientes de moléculas de sinalización.[55][56]
Motilidade
A diferenza da mobilidade na quimiotaxe bacteriana, os mecanismos polos cales as células eucariotas se moven fisicamente non están claros. Parece haber mecanismos polos cales un gradiente quimiosmótico externo é percibido e convertido nun gradiente de PIP3 intracelular, o que resulta nun gradiente e a activación dunha vía de sinalización, culminando na polimerización de filamentos de actina. O extremo distal en crecemento dos filamentos de actina desenvolve conexións coa superficie interna da membrana plasmática por medio de diferentes conxuntos de péptidos e orixina a formación de pseudópodos anteriores e urópodos posteriores. Os cilios das células eucariotas poden tamén producir quimiotaxe; neste caso, é principalmente unha indución dependente de Ca2+ do sistema microtubular do corpo basal e a batida dos microtúbulos con estrutura 9 + 2 do interior dos cilios. O batido orquestrado de centos de cilios está sincronizado por un sistema submembranoso construído entre os corpos basais. Os detalles das vías de sinalización aínda non están totalmente claras.
Respostas migratorias relacionadas coa quimiotaxe

A quimiotaxe é unha migración direccional de células en resposta a gradientes químicos. Existen varias variacións da migración inducida quimicamente, que se indican a continuación:
- A quimiocinese é un incremento na motilidade celular en resposta a compostos químicos do ambiente circundante. A diferenza da quimiotaxe, a migración estimulada pola quimiocinese carece de direccionalidade, e no seu lugar incrementa comportamentos de varrido ou escaneo ambiental.[57]
- Na haptotaxe o gradiente do quimioatractor exprésase ou únese a unha superficie, a diferenza do modelo clásico de quimiotaxe, no cal o gradiente desenvólvese nun fluído soluble.[58] A superficie haptotáctica activa bioloxicamente mais común é a matriz extracelular; a presenza de ligandos unidos é responsable da indución da migración transendotelial e a anxioxénese.
- A necrotaxe é un tipo especial de quimiotaxe na que as moléculas quimioatractoras son liberadas de células necróticas ou apoptóticas. Dependendo do carácter químico das substancias relacionadas, a necrotaxe pode acumular ou repeler células, o que indica a importancia fisopatolóxica deste fenómeno.
Receptores
En xeral, as células eucsriotas perciben a presenxa de estímulos quimiotácticos polo uso de recetores acoplados á proteína G heterotriméricos 7-transmembrana (ou serpentinas), unha clase que representa unha porción significativa do xenoma.[59] Algúns membros desta superfamilia de xenes utilízanse na visión (rodopsinas) e na olfacción.[60][61] As principais clases de receptores quimiotácticos son desencadeados por:
- Formil-péptidos - receptores de formil-péptidos (FPR),
- Quimiocinese - receptores de quimiocinas (CCR ou CXCR), e
- Leucotrienos - receptores de leucotrienos (BLT).[62]
Porén, a indución dun amplo conxunto de receptores de membrana (por exemplo, nucleótidos cíclicos, aminoácidos, insulina, péptidos vasoactivos) tamén causan a migración da célula.[63]
Selección quimiotáctica

Aínda que algúns receptores quimiotácticos se expresan na membrana superficial con características a longo prazo, xa que están determinadas xeneticamente, outros teñen dinámicas a curto prazo, xa que se ensamblan ad hoc en presenza do ligando.[64] As diversas caracterísiticas dos receptores de quimiotaxe e ligandos ofrecen a posibilidade de seleccionar as células que responden quimiotacticamente cun simple ensaio de quimiotaxe por selección quimiotáctica, co que podemos determinar se unha molécula aínda non caracterizada actúa na vía receptora a longo ou a curto prazo.[65] O termo selección qimiotáctica tamén se usa para designar unha técnica que separa células eucariotas ou procariotas segundo a súa resposta quimiotáctica a ligandos selectores.[66]
Ligandos quimiotácticos


O número de moléculas capaces de orixinar respostas quimiotácticas é relativamente alto. Os principais grupos de ligandos primarios son os seguintes:
- Formil-péptidos. Son di-, tri- ou tetrapéptidos de orixe bacteriana formilados no extremo N-terminal do péptido.[67][68] Libéranos as bacterias in vivo ou despois da descomposición da célula. Un exemplo típico deste grupo é a N-formilmetionil-leucil-fenilalanina (abreviado como fMLF ou fMLP).[69] O fMLF bacteriano é un compoñente clave da inflamación e ten efectos quimioatractivos característicos en granulocitos neutrófilos e monocitos.[70] Hai diversos ligandos e receptores quimiotáticos relacionados cos formil-péptidos.
- Moléculas do complemento 3a (C3a) e 5a (C5a). Son produtos intermedios da fervenza do sistema de complemento. Sintetízanse nas tres vías posibles da activación do complemento (clásica, dependente da lectina e alternativa) por un encima convertase.[71][72][73] As principais células diana destes derivados son os granulocitos neutrófilos e monocitos.[74]
- Quimiocinas. Pertencen a unha clase especial de citocinas. O grupos de quimiocinas C, CC, CXC, CX3C son moléculas relacionadas estruturalmente con pontes disulfuro características e unha especificidade de células diana diversa.[75] As quimiocinas CC actúan sobre os monocitos (por exemplo, RANTES), e as CXC son específicas de neutrófilos (por exemplo, IL-8).[76] A investigación das estruturas tridimensionais das quimiocinas proporcionan evidencias de que unha composición característica da folla beta e da hélice alfa proporciona a expresión das secuencias requirida para a interacción cos receptores de quimiocinas.[77] A formación de dímeros e o incremento da súa actividade biolóxica foi demostrado por cristalografía de varias quimiocinas, por exemplo, IL-8.[78]
- Metabolitos de ácidos graxos poliinsaturados
- Leucotrienos. Son lípidos eicosanoides mediadores orixinados no metabolismo do ácido araquidónico polo encima ALOX5 (tamén chamado 5-lipoxixenase). O seu membro máis importante con actividade de factor quimiotáctico é o leucotrieno B4, que causa a adhesión, quimiotaxe e agregación de leucocitos. A acción quimioatractora de LTB4 é inducida por un de dous posibles receptores acoplados á proteína G, BLT1 e BLT2, que son fortemente expresados e células implicadas na inflamación e alerxia.[79]
- Familia dos eicosanoides do ácido 5-hidroxiicosatetraenoico. Son metabolitos do ácido araquidónico tamén formados polo encima ALOX5. Tres membros da familia fórmanse naturalmente e teñen unha actividade quimiotáctica prominente. Estes, listados en orde de potencia decrecente, son: ácido 5-oxo-eicosatetraenoico, ácido 5-oxo-15-hidroxi-eicosatetraenoico e ácido 5-hidroxieicosatetraenoico. Esta familia de agonistas estimula respostas quimiotácticas en eosinófilos, neutrófilos e monocitos humanos ao unirse ao receptor de oxoeicosanoide 1, o cal, igual que os receptores para o leucotrieno B4, é un receptor acoplado á proteína G.[79]
- Ácido 5-hidroxieicosatrienoico e ácido 5-oxoeicosatrienoico. Son metabolitos do ácido de Mead. Estimulan a quimiotaxe dos leucocitos a través do receptor oxoeicosanoide 1[80] e o ácido 5-oxoeicosatrienoico é tan potente coma o seu análogo derivado do ácido araquidónico, o ácido 5-oxo-eicosatetraenoico, na estimulación dos eosinófilos e neutrófilos do sangue humano.[79]
- Ácido 12-hidroxieicosatetraenoico. É un metabolito eicosanoide do ácido araquidónico feito polo encima ALOX12, que estimula a quimiotaxe de leucocitos a través do receptor de leucotrieno B4, BLT2.[79]
- Prostaglandina D2. É un metabolito eicosanoide do ácido araquidónico feito polos encimas ciclooxixenase 1 ou ciclooxixenase 2, que estimula a quimiotaxe a través do receptor de prostaglandina DP2. Orixina respostas quimiotácticas en eosinófilos, basófilos e células T axudantes do subtipo Th2.[81]
- Ácido 12-hidroxiheptadecatrienoico. É un metabolito non eicosanoide do ácido araquidónico feito polos encimas ciclooxixenase 1 ou ciclooxixenase 2, que estimula a quimiotaxe dos leucocitos a través do receptor de leucotrieno B4, BLT2.[82]
- Ácido 15-oxo-eicosatetraenoico é un metabolito eicosanoide do ácido araquidónico feito polo encima ALOX15. Ten unha actividade quimiostática feble para os monocitos humanos (ver ácido 15-hidroxieicosatetraenoico#15-oxo-ETE).[83] O receptor ou outros mecanismos polos cales este metabolito estimula a quimiotaxe non foron dilucidados.
Rango quimiotáctico

As respostas quimiotácticas orixinadas por interaccións ligando-receptor varían coa concentación do ligando. As investigacións de familias de ligandos (por exemplo. aminoácidos ou oligopéptidos) demostran que a actividade quimioatractora ocorre nun amplo rango, mentres que as actividades quimiorrepelentes teñen rangos máis estreitos.[84]
Importancia clínica
O cambio do potencial migratorio das células ten unha importancia relativamente alta no desenvolvemento de varios síntomas e síndromes clínicas. A alteración da actividade quimiotáctica de patóxenos extracelulares (por exemplo, Escherichia coli) ou intracelulares (por exemplo, Listeria monocytogenes) representa unha diana clínica significativa. A modificación da capacidade quimiotáctica endóxena destes microorganismos por axentes farmacéuticos pode facer decrecer ou inhibir a taxa de infeccións ou espallamento de doenzas infecciosas. Ademais de en infeccións, hai outras doenzas nas que a alteración da quimiotaxe é o factor etiolóxico primario, como na síndrome de Chédiak–Higashi, na que vesículas intracelulares xigantes inhiben a migración normal das células.
| Tipo de enfermidade | Incremento da quimiotaxe | Diminución da quimiotaxe |
|---|---|---|
| Infeccións | Inflamacións | SIDA, brucelose |
| A quimiotaxe é resultado da enfermidade | — | síndrome de Chédiak–Higashi, síndrome de Kartagener |
| A quimiotaxe vese afectada | aterosclerose, artrite, periodontite, psoríase, lesión por reperfusión, tumor metastático | esclerose múltiple, enfermidade de Hodgkin, infertilidade masclina |
| Intoxicacións | asbesto, benzopireno | sales de mercurio e cromo, ozono |
Modelos matemáticos
Desenvolvéronse varios modelos matemáticos da quimiotaxe dependendo do tipo de:
- Migración (por exemplo, diferenzas básicas da natación bacteriana, movemento de eucariotas unicelulares con cilios/flaxelos e migración ameboide)
- Características fisico-químicas dos compostos químicos (por exemplo, a difusión) funcionando como ligandos
- Características biolóxicas dos ligandos (moléculas atractoras, neutras e repelentes)
- Sistemas de ensaios aplicados para avliar a quimiotaxe (tempos de incubación, desenvolvemento e estabilidade de gradientes de concentración)
- Outros efectos ambientais que posúen efectos directos ou indirectos inflúen na migración (iluminación, temperatura, campos magnéticos, etc.)
Aínda que as interaccións dos factores listados arriba fan que o comportamento das solucións dos modelos matemáticos da quimiotaxe sexa bastante complexo, é posible describir o fenómeno básico do movemento dirixido pola quimiotaxe de maneira directa. Se notamos como
as concentracións non uniformes espacialmente do quimioatractor e como
o seu gradiente. Entón, o fluxo celular quimiotáctico
(tamén chamado corrente) que se xera pola quimiotaxe está ligado ao gradiente anterior pola lei:[85]
onde
é a densidade espacial das células e
é o denominado "coeficiente quimiotáctico";
adoita non ser constante, senón unha función decrecente do quimioatractor. Para unha cantidade
que está suxeita ao fluxo total
e o termo da xeración/destrución
, é posible formular unha ecuación de continuidade:
onde
é a diverxencia. Esta ecuación xeral aplícase tanto á densidade de células coma ao quimioatractor. Por tanto, incorporando un fluxo de difusión no termo do fluxo total, as interaccións entre estas cantidades están gobernados por un conxunto de ecuacións diferenciais parciais reacción-difusión describindo o cambio en
e
:[85]
onde
describe o crecemento na densidade celular,
é o termo cinética/fonte para o quimioatractor, e os coeficientes de difusión para a densidade celular e o quimioatractor son respectivamente
e
.
A ecoloxía espacial dos microorganismos do solo é función das súas sensibilidades quimiotácticas cara ao substrato e organismos similares.[86] O comportamento quimiotáctico das bacterias leva a padróns de poboación non triviais mesmo en ausencia de heteroxeneidades ambientais. A presenza de heteroxeneidade estrutural a escala de poros ten un impacto extra nos padróns bacterianos emerxentes.
Medida da quimiotaxe
Disponse dunha ampla variedade de técnicas para avaliar a actividade quimiotáctica de células ou o carácter quimioatractor e quimiorrepelente dos ligandos. Os requirimentos básicos para a medición son os seguintes:
- Os gradientes de concentración poden desenvolverse de forma relativamente rápida e persistir durante un longo tempo no sistema.
- Distínguense as actividades quimiotácticas e quimiocinéticas
- A migración de células é libre cara a/afastándose do eixe do gradiente de concentración
- As respostas detectadas son o resultado das células en activa migración.
A pesar de que aínda non se dispón dun ensaio de quimiotaxe ideal, hai varios protocolos posibles e equipamentos que ofrecen unha boa correspondencia coas condicións descritas arriba. Os usados máis habitualmente resúmense na táboa de abaixo:
| Tipo de ensaio | Ensaios en placa de ágar | Ensaios de dúas cámaras | Outros |
|---|---|---|---|
| Exemplos |
|
|
|
Sistemas quimiotácticos artificiais
Deseñáronse robots químicos que usan a quimiotaxe artificial para navegar autonomamente.[87][88] As aplicacións inclúen a entrega dirixida a diana de fármacos no corpo.[89] Máis recentemente, as moléculas encimáticas mostraron tamén comportamentos quimiotácticos nun gradiente dos seus substratos.[90] A unión termodinamicamente favorable de encimas aos seus substratos específicos recoñécese como a orixe da quimiotaxe encimática.[91] Adicionalmente, os encimas de fervenzas encimáticas tamén mostraron agregación quimiotáctica dirixida por substrato.[92]
Ademais dos encimas activos, as moléculas non reactivas tamén teñen comportamento quimiotáctico. Isto demostrouse usando moléculas de tinturas que se moven direccionalmente en gradientes de solución de polímeros por medio de interaccións hidrófobas favorables.[93]
Notas
Véxase tamén
Outros artigos
- Índice de McCutcheon
- Tropismo
- Durotaxe
- Haptotaxe
- Mecanotaxe
- Plitotaxes
- Capas delgadas (oceanografía)
Bibliografía
- Modelo:Cite book
- Modelo:Cite journal
- Modelo:Cite book
- Modelo:Cite book
- Modelo:Cite book
- Modelo:Cite book
- Modelo:Cite book
- Modelo:Cite journal
- Modelo:Cite book
- Modelo:Cite book
- Modelo:Cite journal
- Modelo:Cite journal
Ligazóns externas
- Quimiotaxe
- Quimiotaxe de neurrófilos
- Portal de migración celular
- Simulaqdor da quimiotaxe descargable de Matlab Modelo:Webarchive
- Simulador interactivo da quimiotaxe bacteriana (web-app)
- ↑ Modelo:DiGalego
- ↑ Modelo:Cite EB1911
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ 9,0 9,1 Modelo:Cite journal
- ↑ Chemotaxis Lecture. Uploaded in 2007. available at: http://www.rpgroup.caltech.edu/courses/aph161/2007/lectures/ChemotaxisLecture.pdf Modelo:Webarchive (Consultado o: 15/04/17)
- ↑ Élie Metchnikoff". Encyclopædia Britannica. Encyclopædia Britannica, Inc.
- ↑ Keller-Segel Models for Chemotaxis. 2012. available at: http://www.isn.ucsd.edu/courses/Beng221/problems/2012/BENG221_Project%20-%20Roberts%20Chung%20Yu%20Li.pdf Modelo:Webarchive (Consultado en abril de 2017)
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite book
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite web
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite book
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite book
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite book
- ↑ 29,0 29,1 Modelo:Cite journal
- ↑ Modelo:Cite web
- ↑ Jahreis K, Morrison TB, Garzón A, Parkinson JS. Chemotactic signaling by an Escherichia coli CheA mutant that lacks the binding domain for phosphoacceptor partners. J Bacteriol. Maio de 2004 ;186(9):2664-72. doi: 10.1128/JB.186.9.2664-2672.2004. PMID: 15090507; PMCID: PMC387806.
- ↑ Modelo:Cite journal
- ↑ Toker, A. S., & Macnab, R. M. (1997). Distinct regions of bacterial flagellar switch protein FliM interact with FliG, FliN and CheY. Journal of molecular biology, 273(3), 623–634. https://doi.org/10.1006/jmbi.1997.1335
- ↑ 34,0 34,1 34,2 34,3 Modelo:Cite journal
- ↑ Modelo:Cite book
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ 39,0 39,1 39,2 39,3 39,4 39,5 Modelo:Cite journal
- ↑ 40,0 40,1 Modelo:Cite journal
- ↑ 41,0 41,1 41,2 Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cita libro
- ↑ Modelo:Cite journal
- ↑ 46,0 46,1 46,2 46,3 Modelo:Cite journal
- ↑ 47,0 47,1 47,2 47,3 Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ 49,0 49,1 Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite book
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite book
- ↑ Modelo:Cite book
- ↑ Modelo:Cite journal
- ↑ Wayne A. Marasco, Sem H. Phan, Henry Krutzsch, Henry J. Showell, Douglas E. Feltner, Roderick Nairn, Elmer L. Becker, e Peter A. Ward. Purification and Identification of Formyl-Methionyl-Leucyl-Phenylalanine As the Major Peptide Neutrophil Chemotactic Factor Produced by Escherichia coli. The Journal of Biological Chemistry. Vol. 259, No. 9, 10 de maio, pp. 5430-5439,1984 [1]
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Arbour, N., Tremblay, P., & Oth, D. (1996). N-formyl-methionyl-leucyl-phenylalanine induces and modulates IL-1 and IL-6 in human PBMC. Cytokine, 8(6), 468–475. https://doi.org/10.1006/cyto.1996.0063
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Complement Component C3a. C3a is a 77-amino-acid protein released from the α-chain of C3 by either the classical or alternative pathway C3 convertases. De: Encyclopedia of Biological Chemistry (2ª edición), 2013 [2]
- ↑ Broxmeyer, H. E., Kim, C. H., Cooper, S. H., Hangoc, G., Hromas, R., & Pelus, L. M. (1999). Effects of CC, CXC, C, and CX3C chemokines on proliferation of myeloid progenitor cells, and insights into SDF-1-induced chemotaxis of progenitors. Annals of the New York Academy of Sciences, 872, 142–163. https://doi.org/10.1111/j.1749-
- ↑ Bajt, M. L., Farhood, A., & Jaeschke, H. (2001). Effects of CXC chemokines on neutrophil activation and sequestration in hepatic vasculature. American journal of physiology. Gastrointestinal and liver physiology, 281(5), G1188–G1195. https://doi.org/10.1152/ajpgi.2001.281.5.G1188
- ↑ Clore, G. M., & Gronenborn, A. M. (1995). Three-dimensional structures of alpha and beta chemokines. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 9(1), 57–62. https://doi.org/10.1096/fasebj.9.1.7821760
- ↑ Rajarathnam K, Prado GN, Fernando H, Clark-Lewis I, Navarro J. Probing receptor binding activity of interleukin-8 dimer using a disulfide trap. Biochemistry. 27 de xuño de 2006; 45(25):7882-8. doi: 10.1021/bi0605944. PMID: 16784240; PMCID: PMC2518044.
- ↑ 79,0 79,1 79,2 79,3 Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ 85,0 85,1 Modelo:Cite book
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal
- ↑ Modelo:Cite journal